分子をつなげて価値を生む合成化学
1. 研究の歴史(合成化学を基盤としたスーパー分子創製への道のり)
分子には科学・技術のあり方を変え、ひいては社会をも変容させる力があります。この地球上には実に多くの問題が存在しますが、それらに対して「分子で答えを出す」ことができると信じています。私の夢は、問題を解決するような画期的な機能をもつ分子や構造的に美しい分子(美しい分子には機能が宿る)を開発し、世に送り出すことです。これまでに開発した23種の分子(分子ナノカーボン、反応剤、触媒、配位子、生物活性分子)が既に市販化され、世界中の研究者が用いています。
学生時代に京都大学とスウェーデン・ウプサラ大学で有機化学、生体関連化学ならびに有機金属化学、触媒化学、合成化学を学び、その後の分子や合成化学を基盤とした新物質創製研究の基礎を築きました。京都大学助手時代には、様々な分野への波及効果のある多様性指向型合成化学を目指し、新合成方法論の開拓と機能性有機分子の創製に取り組みました。
33歳の時に研究グループ(当時は野依特別研究室)を率いる機会を名古屋大学に得た際は、標的分子群をさらにインパクトのあるものに設定し、材料科学やケミカルバイオロジーへの波及効果のある合成化学をさらに強力に進めました。特に、有機化学や合成化学を基盤とした「分子ナノカーボン科学」という新領域を開拓しました[1]。カーボンナノリング、カーボンナノベルト、ワープドナノグラフェン、インフィニテンに代表される数多くの「新しい炭素のカタチ」を世に送り出すことができました。アメリカ化学会Chemical & Engineering Newsが選ぶMolecule of the Yearにも何度か選出されました。企業との共同研究によって分子ナノカーボンが有機エレクトロニクスなどの材料科学分野で活躍の場を見せており、分子ナノカーボン科学は今や基礎と応用の両面で化学における一大潮流となりました。
さらに、分子ナノカーボン科学の推進と並行して、研究者として新たな挑戦をすべく、名古屋大学トランスフォーマティブ生命分子研究所(ITbM)[2]を世界トップレベル研究拠点(WPI)の一つとして立ち上げ(設立拠点長)、合成化学・植物科学・動物科学・理論化学の融合領域を開拓しました。
2024年4月には、研究の拠点を理化学研究所に移し、分子創造化学の開拓研究をスタートさせました。
以下、これまでの主な研究の概要と今後の研究の方向性を示します。

2. これまでの主な研究の概要
2-1. プログラム分子構築と迅速合成触媒の開発
京都大学助手時代にプログラム分子構築の概念を打ち出し、そのための新しい手法(着脱可能な分子内配位子法や迅速合成触媒など)を開発しました[3]。プログラム分子構築の力量を示す例として、一般性のある自在合成法がなかった多置換オレフィンと拡張π電子系を主に取り上げ、それらの多様性指向型合成を達成するとともに、多彩配色蛍光分子や抗がん剤候補分子のライブラリーを構築しました。京都大学時代に開発した6化合物は市販化されるに至りました。
2-2. 分子ナノカーボン科学の開拓
フラーレン、カーボンナノチューブ、グラフェンに代表されるナノカーボンは物質科学に革命を起こしました。しかし、この分野には2つの大きな未解決問題がありました。例えば、カーボンナノチューブやグラフェンは、現在の合成法では構造的に純粋な分子として合成することができません。また、理論的に提案されているに留まっている新奇な構造のナノカーボンも数多くあります。したがって、構造的に純粋あるいは全く新しいナノカーボンを提供する合成化学の開拓は、未来の物質科学の扉をひらく鍵といえます。ナノカーボンを構造的に純粋な分子として自在に合成・活用・理解することを目指し、有機化学や合成化学を基盤とした「分子ナノカーボン科学」という新領域を開拓し、ナノカーボン科学が抱えていた「混合物問題」と「合成不可能問題」に対して明快な解決法を出しました[1]。
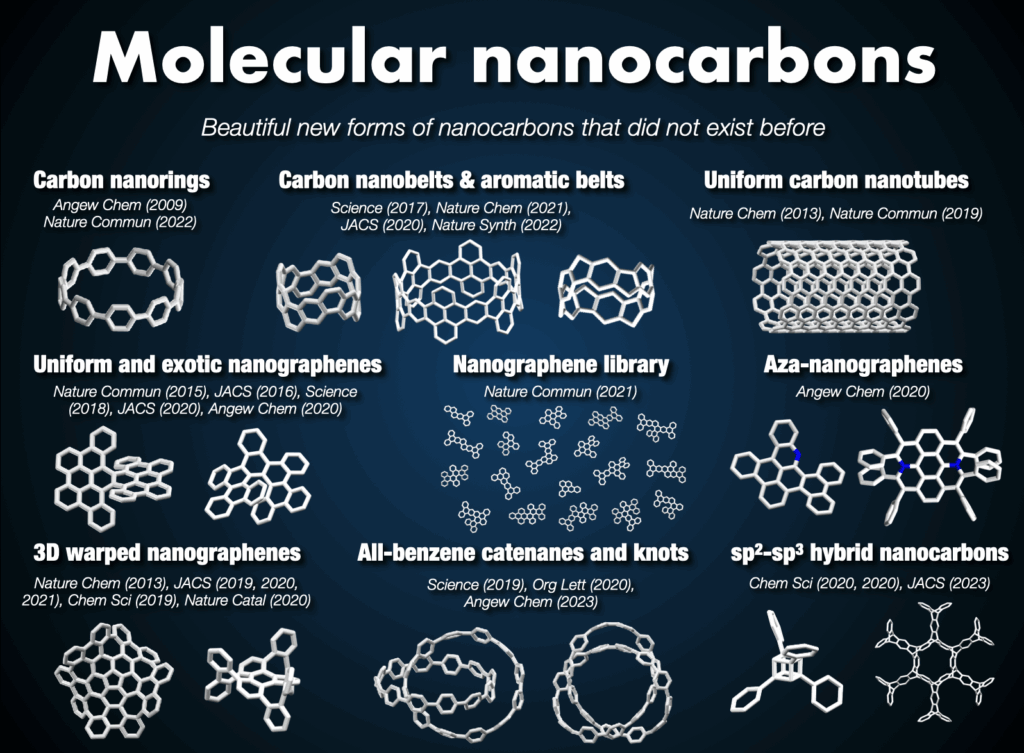
2-3. カーボンナノリング・カーボンナノベルトの合成
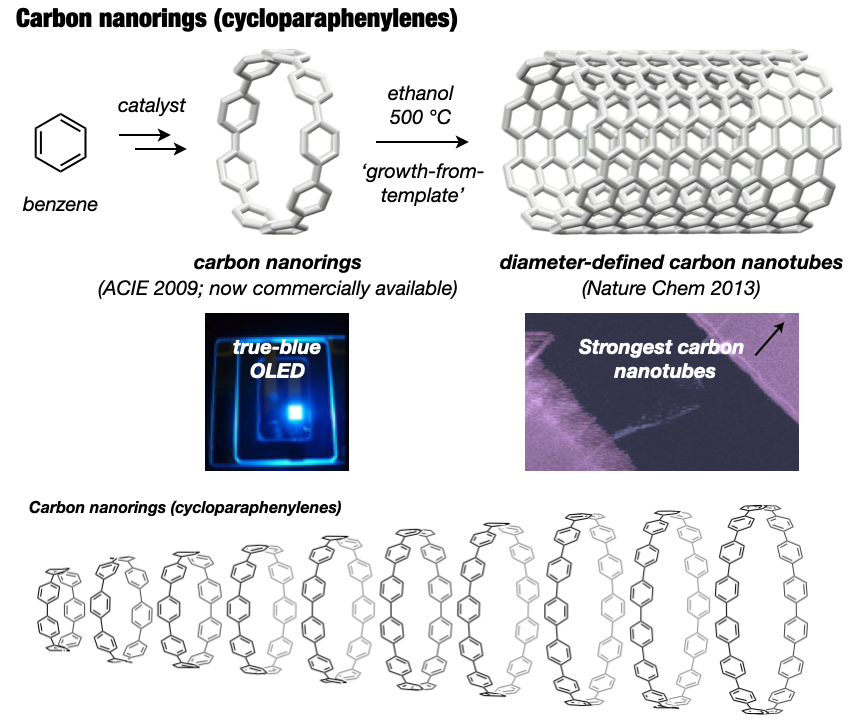
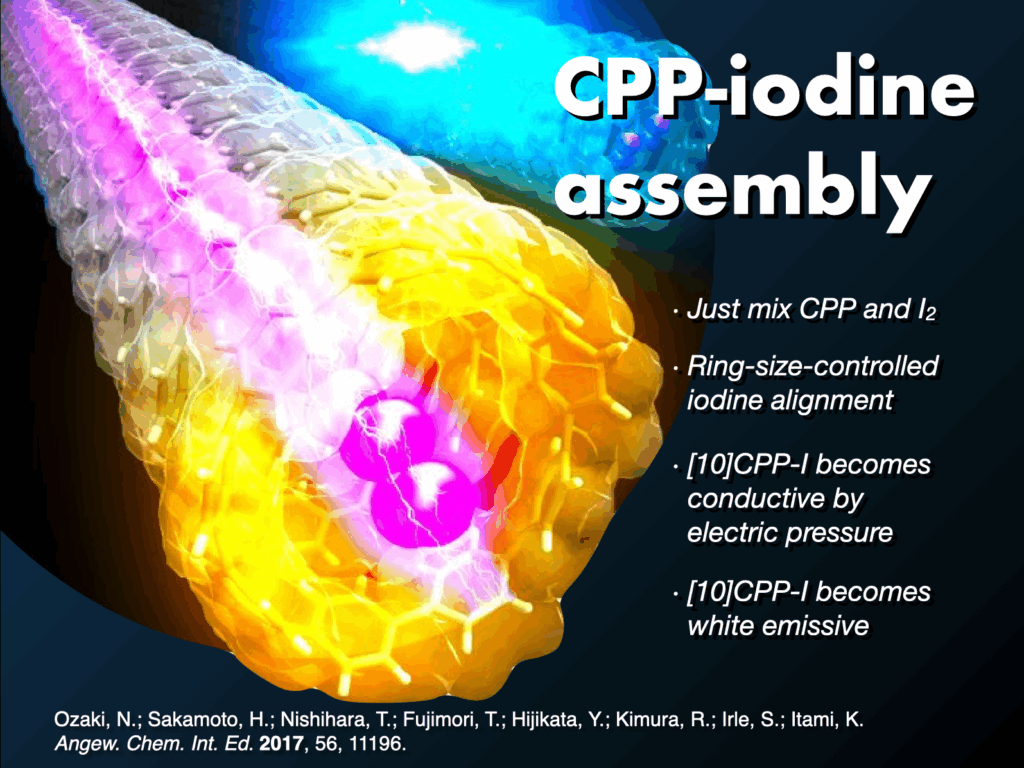
長年難攻不落とされていた究極のターゲットとして、構造的に純粋なカーボンナノチューブといえるカーボンナノリングとカーボンナノベルト(短尺ナノチューブ)の世界初の合成を目指しました[4]。2009年にカーボンナノリング(シクロパラフェニレン: CPP)の合成を達成しました[5]。米国Bertozziのグループ[6]と独立かつ同時期に世に送り出したCPPはその後世界中で研究展開され、最近ではデバイス等での実用化研究も進んでいます。代表的な成果としては、CPPの効率的合成法の開発、CPP(7化合物)の市販化[7]、全フッ素化CPP[8]やメチレン架橋CPP(市販化)[9,10]などの各種誘導体の合成、CPPの特異な光電子物性の発見、ホストゲスト化学などの超分子化学への展開[11]、刺激応答性材料の創製[12]、バイオイメージングへの応用、CPPを鋳型としたカーボンナノチューブ合成[13]があります。

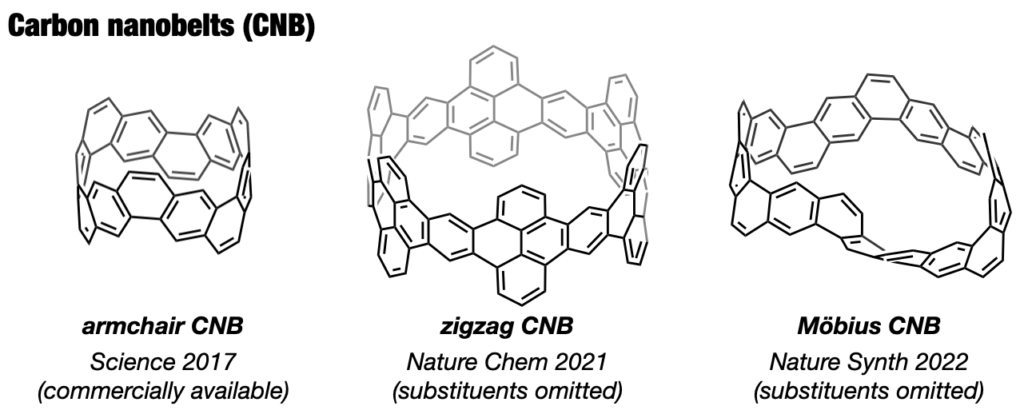
CPPと同様にカーボンナノチューブの部分構造でありながら、ナノチューブが発見される前から60年以上に渡って化学者の合成標的となっていた分子がカーボンナノベルト(CNB)です。本来剛直な平面分子であるベンゼンを極度にひずませた形ゆえ、長く化学者の挑戦を退け続けてきました。12年にわたる検討の末、2016年についにCNBの世界初の合成を達成しました[14]。最初に合成したのは(6,6)CNBですが、直径のより大きな(8,8)CNBや(12,12)CNBの合成にも成功し、特異な光電子物性や環サイズ効果を明らかにしました[15]。さらに東京化成工業による大スケールでの合成と市販化が実現し、CNBは唯一無二のベルト状分子として各方面で使われるようになりました[16]。その後、zigzag型CNB[17]やメビウス型CNB[18]の合成にも成功しました。私たちが拓いたカーボンナノリングとカーボンナノベルトの化学は今や化学における一大潮流となっています。

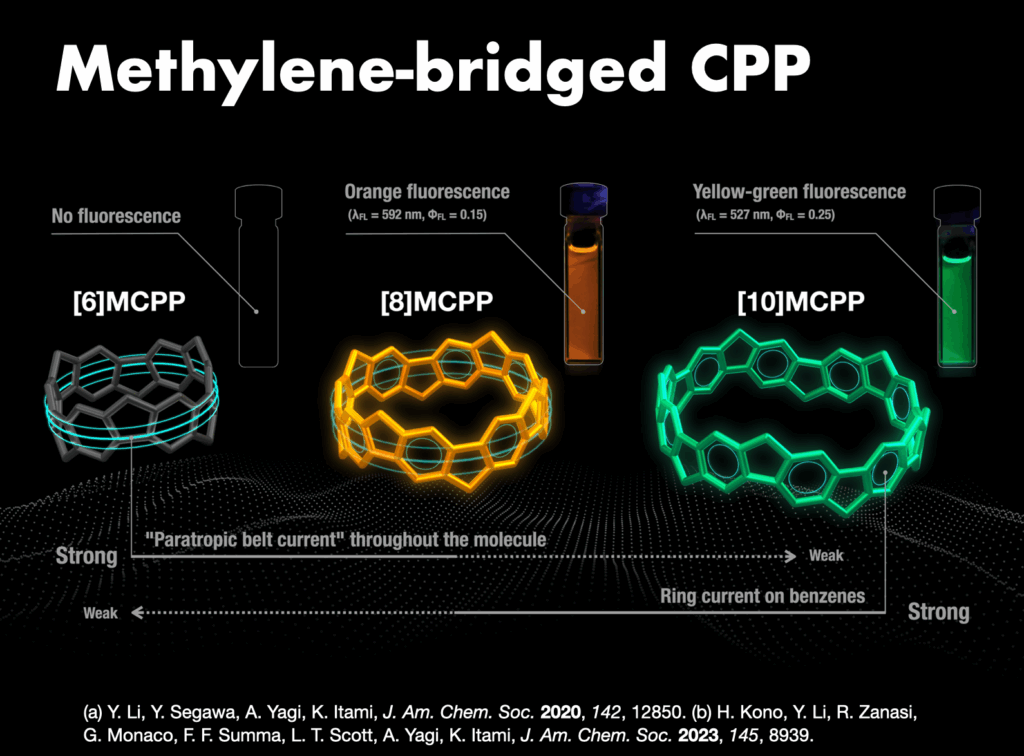

2-4. ユニークな幾何学構造をもつ分子ナノカーボンの合成と機能開拓
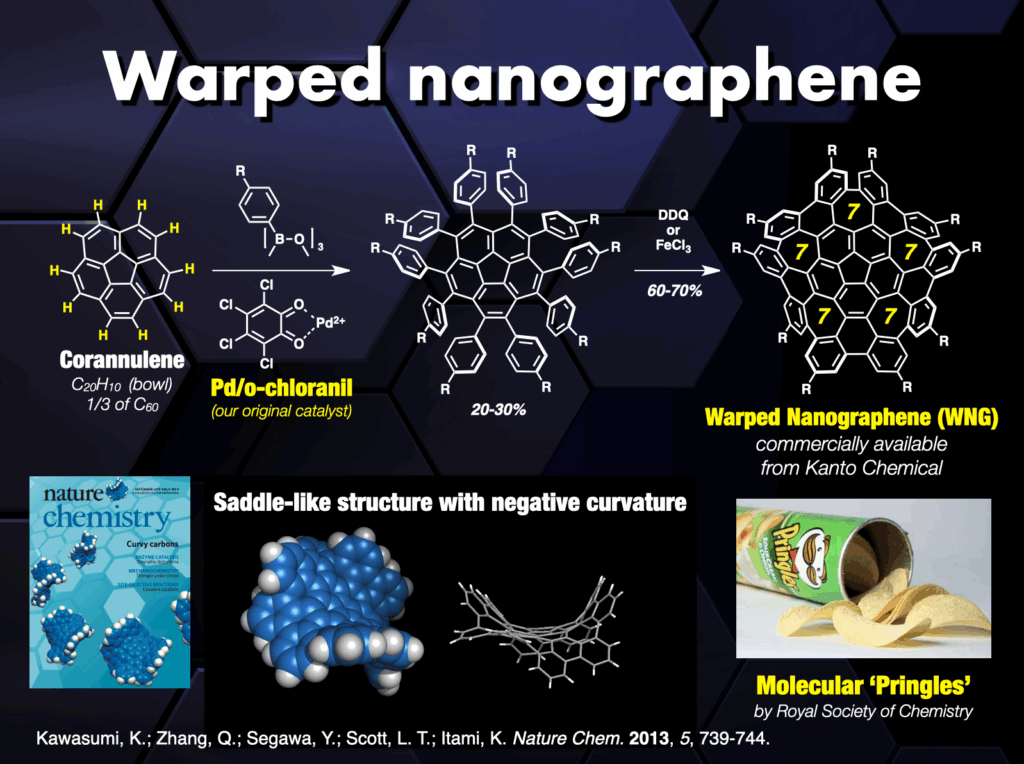
CPPやCNBに限らず、炭素原子の繋ぎ方には無限の可能性があり、「新しい炭素のカタチ」に夢とロマンを感じながら研究を行ってきました。例えば、カーボンナノケージ[19]、オールベンゼン・カテナンやトレフォイルノット[20]、3次元状に湾曲したナノグラフェン(ワープドナノグラフェン、市販化)[21,22]、拡張多重ヘリセン[23]や8の字型キラル分子インフィニテン[24]の合成に成功し、新奇分子ナノカーボンのユニークな機能を明らかにしました。この間、ERATOプロジェクトを通じて、ナノカーボン合成化学と物性物理[25]や超分子・炭素材料化学[26]との融合領域を開拓しました。また、企業との共同研究によって分子ナノカーボンは有機エレクトロニクスなどの材料科学分野で活躍の場を見つけています。



2-5. 直感的な分子レゴを実現する新反応・新触媒の開発
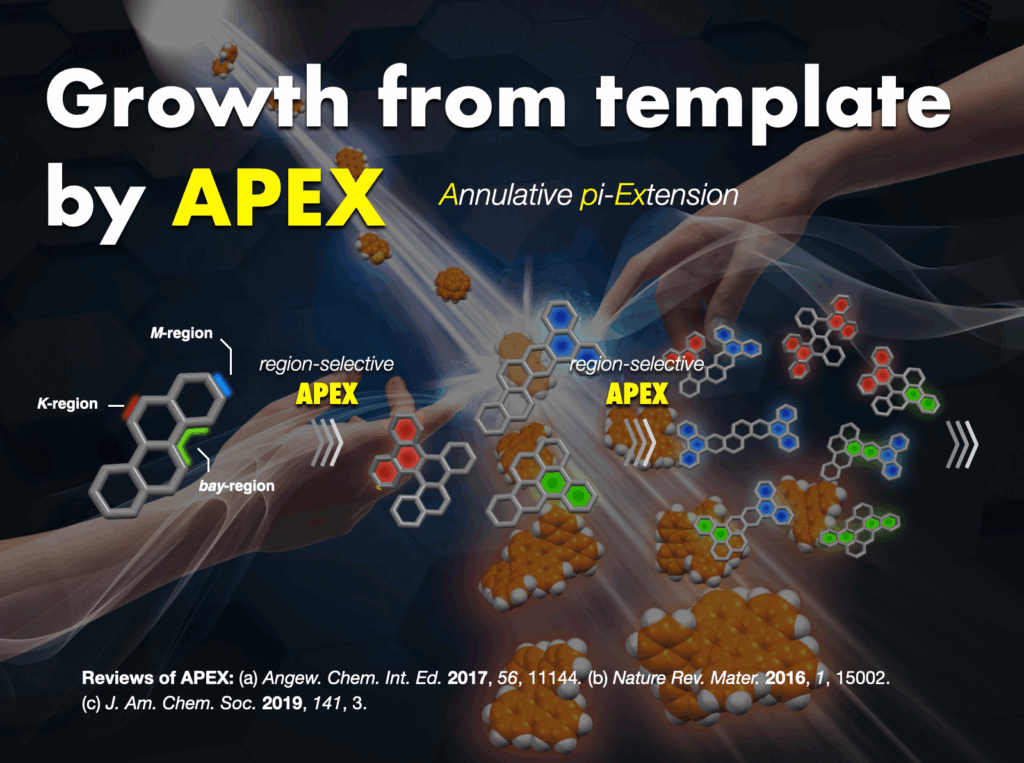
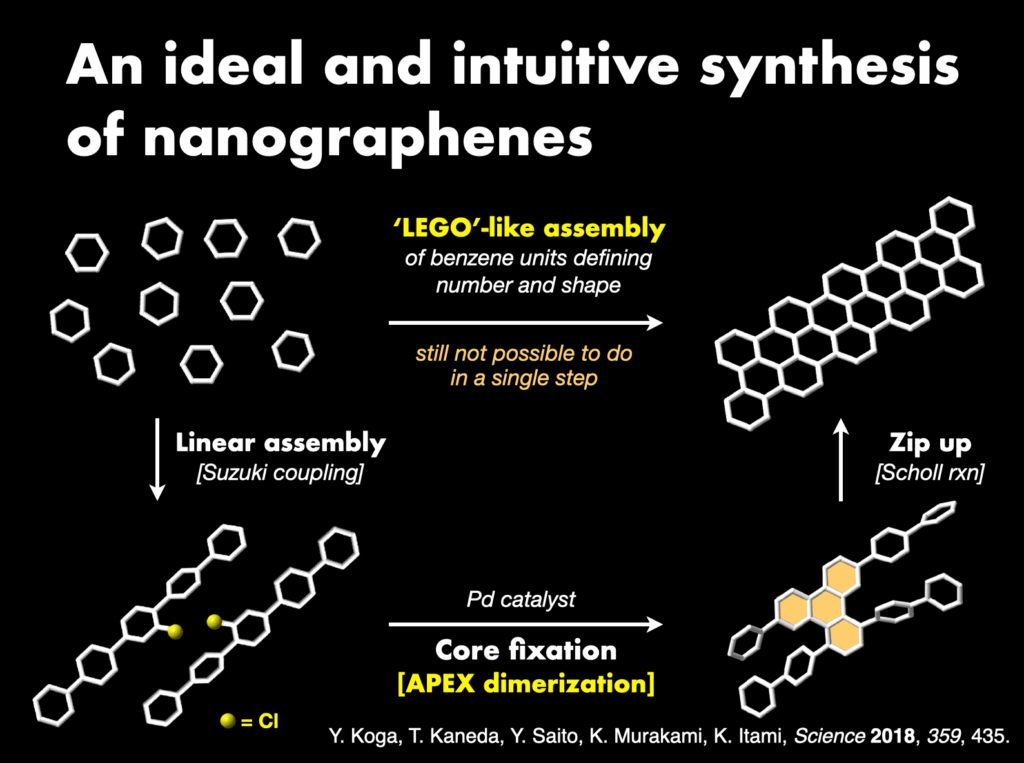
多様な構造をもつ分子を標的とする私たちにとって、それらを創りあげる合成化学の力量は生命線です。教科書的には不可能であっても「直感的」かつ「直接的」に分子を活性化し連結する新しい化学反応を数多く開発してきました。例えば、天然から豊富に得られる芳香族化合物そのものの炭素–水素(C–H)結合を直接的に活性化し、分子ナノカーボンなどの芳香環連結分子を迅速に合成してきました。私たちが開発した独自のC–H変換触媒(約20種類)[27]は、世界中の研究者によって日常的に使われています。既に9つの触媒・配位子・反応剤が市販化されています。さらに、ナノグラフェンの迅速合成や直接変換を可能にする新しい合成方法論として、縮環π拡張(APEX)反応[28]を提案・開発し、種々の機能性分子ナノカーボンの創製につなげてきました。


2-6. ITbMの立ち上げと植物学者・動物科学者・理論化学者との協働
2012年に名古屋大学にトランスフォーマティブ生命分子研究所(ITbM)を立ち上げ、異分野の研究者が垣根なく自由に研究するMix-Labコンセプトを打ち出し、「分子で世界を変える」をスローガンに分野融合新領域を開拓しました[2]。ITbMではケミカルバイオロジーや合成化学のエッセンスを植物科学や動物科学に取り入れ、植物ケミカルバイオロジー、化学時間生物学、化学主導型イメージング科学などの新領域を開拓しました。ITbMの設立拠点長として最先端研究を牽引するとともに、主任研究者として寄生植物ストライガ抑制分子[29]、気孔制御分子[30]、生物時計制御分子[33]、植物受精効率向上分子[34]を数多く開発しました。今やITbMは世界をリードする異分野融合国際研究所に成長しました[35]。


3. 今後の研究の方向性
合成化学は価値を創造できる、最高にクリエイティブな学問です。想像力(imagination: 分子設計)と創造力(creativity: 分子連結・変換技術)さえあれば、標的は尽きることはありません。必要なのは分子模型と力量ある化学反応です。さらにいえば、物性や機能にも無限の可能性があります。フラーレンの研究が象徴的ですが、新しい炭素のカタチには、発見当時には予想すらしなかった全く未知あるいは破格の新物性や新機能が隠されているものです。美しいものには必ず機能が宿ることは歴史が証明しています。
分子には世界を変えるチカラがあります。科学の歴史を紐解くと、新分子の創製・発見や破格の物性や機能の発見といった分子自体に関わる発見が非線形のブレークスルーを生み出してきました。また、常識では関連性が明らかではない分子や分野をつなげることによって新しい価値が生まれ、イノベーションへと昇華されることもあります。スティーブ・ジョブズの名言 “connecting the dots” に明快に示されたイノベーションの真髄です。
今後、理化学研究所では上記のイノベーション因子を同時に満たす分子を創造することを目指しています。構造美と破格機能を併せもつ唯一無二の分子を創製し、様々な分野間の境界領域で自らの分子を活躍させるとともに未踏領域を開拓することを目指しています。主に分子ナノカーボンにフォーカスして、その画期的な分子編集・操作法の開発(ナノカーボン・クリック化学)、破格マテリアル機能の創出(分子ナノカーボンマテリアル科学)、生物学・創薬展開(分子ナノカーボンバイオロジー)の3本柱で分子創造化学を推進していきます。

3-1. ナノカーボン・クリック化学
ナノグラフェンに代表される縮環芳香族化合物は、有機薄膜トランジスタ、太陽電池、有機ELなどの電子材料に頻繁に用いられる重要な化合物群であるばかりでなく、未来材料と目されるナノカーボンを「分子」としての利活用を可能にする「分子ナノカーボン」としても極めて注目度が高いです。しかし、分子ナノカーボン合成には「多段階工程問題」や「合成不可能問題」といった諸問題を抱えています。これまで私たちは分子ナノカーボンや縮環芳香族化合物の合成を一新するような新合成方法論(APEX反応など)を開拓し、この分野で世界をリードしてきましたが、この分野のさらなる発展には、新しい反応化学が拓く分子ナノカーボン科学の確立が絶対的に必要不可欠です。さらに、今後の研究の柱とする「分子ナノカーボンバイオロジー」への展開においても魅力ある分子ナノカーボンを生物応用する際に、合成の難しさがボトルネックになることが予想されるため、真に有用な基本的合成方法論が必要です。今後展開する分子ナノカーボンバイオロジー研究や分子ナノカーボンマテリアル科学研究に限らず、幅広い分野において大きなインパクトをもたらす新コンセプトとして、「ナノカーボン・クリック反応」を開発します。
分子ナノカーボンに限らず有機エレクトロニクス材料、プラスチック、医農薬、タンパク質、アミノ酸等の「機能性」分子には必ずと言っていいほどベンゼン環が含まれています。様々な機能を生み出すユビキタス骨格と言っても過言ではありません。ただ、一般的にベンゼン環は安定で反応性が低く、それ故機能性分子の骨格に用いられてきた側面もあります。もし、ここでベンゼン環に「選択的」かつ「温和」な条件で官能基化(クリック反応)することができれば、全く世界が変わるはずです。私たちはこれまで分子ナノカーボンや生物活性分子のベンゼン環の直接変換(触媒的C-H活性化)やAPEX反応を開発してきましたが、反応性や選択性が不十分(高温や触媒が必要)であるのはもちろんのこと、細胞内直接変換など夾雑系に適用可能なレベルにはまだ達していませんでした。2022年のノーベル化学賞に輝いたクリック反応のレベルにまで反応の力量を高めることを目標に、ナノカーボン構造やベンゼン環を標的にしたクリック化学(ナノカーボン・クリック化学)を確立します。ナノカーボン・クリック化学は、分子ナノカーボンマテリアル科学と分子ナノカーボンバイオロジーの両方への展開を可能にする鍵となるのは必定です。
3-2. 分子ナノカーボンマテリアル科学
これまで数多くの分子ナノカーボンの合成と機能開拓を行ってきましたが、構造と機能の両面でこれまでの分子を遥かに凌駕する唯一無二分子を創製したいと思っています。フラーレンを超える分子を世に送り出すことが究極のゴールです。
3-2-1. 究極の分子ナノカーボンの合成
これまで様々な湾曲構造ならびに平坦構造をもつ分子ナノカーボンの合成に成功してきましたが、理化学研究所ではなかでも究極の構造といえる3つの分子の合成に注力したいと思っています。具体的な分子構造については、今後紹介していきたいと思っています。
3-2-2. オール炭素エレクトロニクス材料
正孔を輸送する(正孔輸送)、電子を輸送する(電子輸送)、程良く電気を通す(半導体)、光る(発光)などの基本物性を示す材料は有機エレクトロニクス分野における必須材料です。これまでこの分野は優れた有機材料の発見や開発を通じて爆発的な発展を遂げてきました。正孔輸送材料といえば窒素原子を含むトリアリールアミン、電子輸送材料といえば電子不足ヘテロ環やフラーレン誘導体、有機半導体といえばポリチオフェンやオリゴチオフェンの独壇場です。これら分子群の大きな特徴は望みの物性発現のためにヘテロ元素を導入している点ですが、この「常識」を覆したいと思っています。すなわち、炭素原子と水素原子のみからなるオール炭素エレクトロニクス材料を新しい標準物質として世に送り出し、この分野に非線形のブレークスルーをもたらしたいと思っています。
3-2-3. ナノカーボンの構造物性マッピング
上記の材料開発は、合成化学に強みをもつ私たちでも従来型の「分子設計→合成→物性評価」アプローチでは、とてつもない時間とマンパワーが必要となります。ナノグラフェンの構造多様性が極めて大きいからです。例えば、6員環が10以下の多環芳香族炭化水素・ナノグラフェンに限っても理論上可能な構造は20,620にものぼります。しかも、これらの分子群は極めてシンプルであるにも関わらず、ほとんどが合成されたことがないものばかりです。私たちは、量子化学計算、機械学習、AI、自動合成などを駆使して、分子ナノカーボンの構造物性マップを作成します。望む物性を発現する候補分子群を絞り込み、私たちの最先端ナノカーボン合成技術によってゴールに最速で辿り着きたいと思っています。ここで得られるナノグラフェンや分子ナノカーボンの構造物性マップは、世界中の研究者がそれぞれの目的で活用できる「周期表」のようなものとなり、化学における大きな財産となると思っています。
3-3. 分子ナノカーボンバイオロジー
分子ナノカーボンには、従来の生体機能分子にはない魅力的な特徴(広い2次元π平面、2次元・3次元構造の自在構築、光・電子応答性、生体直行性)があるため、これらを積極的に活かした分子設計によってバイオ革新をもたらす分子ナノカーボンが創製できると確信しています。今後こだわりたい「分子ナノカーボンバイオロジー」の概念は、すでに材料科学分野で社会波及効果が見え始めているナノカーボンに新しい価値と創造を与えると思っています。
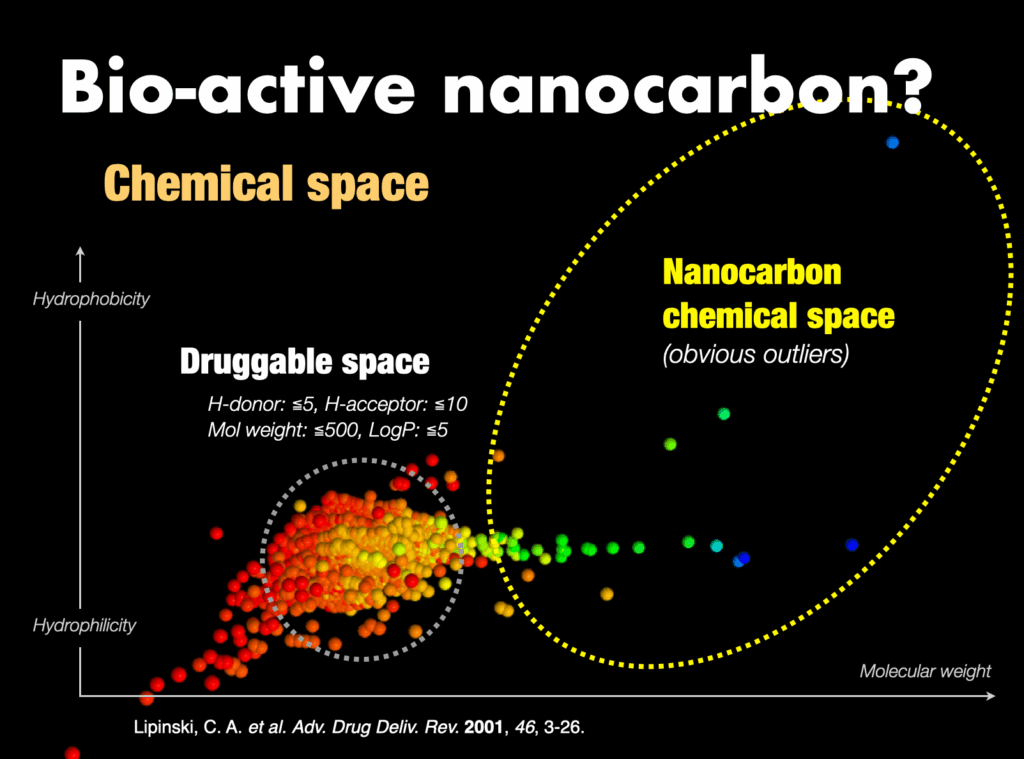

3-3-1. 生物活性分子ナノカーボン
これまで、創薬のための経験則として、医薬品らしさの基準(例えばリピンスキーの法則)が提唱されてきました。ナノカーボンのケミカルスペースは医薬品らしさの基準から大きく外れるので、ナノカーボンに生物活性があるとは誰も思っていません。しかし、本気の検証が行われていなかったのが現状です。最近私たちは生物活性ナノカーボン分子をいくつか発見しました。これらは、間違いなく新たな潮流を生み出すもので、また生物活性分子の新しい指導原理につながるものです。各製薬会社の研究によってリピンスキーの法則に基づくケミカルスペースからの医薬品はほぼ探索し尽くされており、新規医薬品の発見は世界的にも困難な状況にあります。ここにブレークスルーをもたらすのは、間違いなくアウトライアーで、分子ナノカーボンにはその意味でも大きな可能性があります。本研究の成功は従来のケミカルスペースを大きく拡張することを意味しており、新たな探索領域に基づく創薬研究分野の新潮流が生まれると期待されます。
3-3-2. 分子ナノカーボンを用いたタンパク質間相互作用の精密制御
生物活性の中でも特に高価な抗体医薬が先行しているタンパク質間相互作用(PPI)を制御するPPI創薬がナノカーボンの特徴を際立たせることのできる方向性だと確信しています。PPIは細胞増殖や分化、シグナル伝達など数多くの生命現象に関わり、新たな創薬ターゲットとして注目されています。通常の有機小分子で達成困難ですが、分子ナノカーボンが有する広いπ平面と特異的な物性を活用すればPPIの精密制御が可能になると考えているます。実際、独自のナノカーボンライブラリーを用いた予備的なスクリーニングを行った結果、高度なPPI制御が可能な分子ナノカーボンを最近発見しました。今後、分子の構造最適化や構造生物学的研究に加えて、創薬検証も行い、治療薬開発につながる学術基盤を構築します。分子ナノカーボンは高い疎水性と数多い芳香環に由来してπ–π相互作用を生じやすい分子群であるため、PPI制御分子の新しい標準になる潜在能力をもつと考えています。
3-3-3. 分子ナノカーボンを用いたタンパク質・核酸輸送
タンパク質や核酸といった生体高分子は、基礎研究で用いられることはもちろんのこと、近年では医薬品(抗体医薬、核酸医薬など)、ゲノム編集ツールとして応用が期待されています。特にタンパク質の直接導入は,核酸を用いたタンパク質発現と比較して転写、翻訳、翻訳後修飾を必要としないため、機能発現のタイミングが重要なiPS細胞の作製や、細胞の分化誘導に最適です。しかし一般的に生体高分子はその大きさ、および表面電荷の影響で膜透過能が非常に低いという問題があります。最近、独自に設計・合成した分子ナノカーボンが、哺乳類細胞において核酸輸送能を有していること発見しました。さらに、核酸に比べて輸送が困難なタンパク質を細胞内へ輸送する分子ナノカーボンも発見しました。今後、基礎と応用の両面で益々重要になってくるタンパク質・核酸輸送の全く新しい標準物質群を開発していきたいと思っています。
3-3-4. ナノカーボンペプチド
魅力的な物性をもつナノカーボンを生物分野と材料科学分野で広く活躍するペプチドに組み込むことで、新たな物質群ナノカーボンペプチドを創製し、その化学を開拓したいと思っています。ナノカーボンの高い生体直交性とペプチドの高い生体適合性を組み合わせれば生体内環境に左右されない生体適合材料として生物分野で活躍することが期待されます。また、ナノカーボンの特徴的なπ平面を、集合構造を構築するペプチドに組み込むことで新奇集合様式をもつ超分子材料として材料分野で活躍することも期待されます。分子ナノカーボンに異次元の活躍をさせる新たなconnecting-the-dotsハイブリッド分子群であるナノカーボンペプチドには無限の可能性があります。
これら以外にも様々な研究テーマを考えております。今後、随時紹介していきたいと思います。
4. 市販化された化合物 (22化合物)
[15]Cycloparaphenylene, [15]CPP (Kanto Chemical)
[12]Cycloparaphenylene, [12]CPP (TCI, Kanto Chemical)
[11]Cycloparaphenylene, [11]CPP (TCI)
[10]Cycloparaphenylene, [10]CPP (TCI)
[9]Cycloparaphenylene, [9]CPP (TCI, Kanto Chemical)
[8]Cycloparaphenylene, [8]CPP (TCI)
[7]Cycloparaphenylene, [7]CPP (TCI)
Methylene-bridged [6]cycloparaphenylene, [6]MCPP (TCI)
(6,6)Carbon nanobelt bis(tetrahydrofuran) adduct, (6,6)CNB (TCI)
Warped nanographene, WNG (Kanto Chemical)
[1,2-Bis(dicyclohexylphosphino)ethane]dicarbonylnickel(0), Ni(dcype)(CO)2 (Kanto Chemical)
3,4-Bis(dicyclohexylphosphino)thiophene, dcypt (Kanto Chemical)
2,2‘-Bis[bis(3,5-dimethylphenyl)phosphino]-1,1’-biphenyl, Xyl-BIPHEP (TCI)
5-Adamantyl-IAA, super-strong auxin (TCI)
Yoshimulactone Green, YLG (TCI)
AMOR, glyco-enhancer of plant fertilization (TCI)
Vinylboronic acid pinacol ester (TCI, Sigma-Aldrich)
Bis[dimethyl(2-pyridyl)silyl]methane (TCI)
2-(Allyldimethylsilyl)pyridine (Sigma-Aldrich)
2-(Dimethylvinylsilyl)pyridine (TCI, Sigma-Aldrich)
2-(Trimethylsilyl)pyridine (TCI, Sigma-Aldrich)
2-(Dimethylsilyl)pyridine (Sigma-Aldrich)
5. 参考文献
-
-
- Accounts and reviews: (a) Y. Segawa et al., “Structurally uniform and atomically precise carbon nanostructures”. Nature Rev. Mat. 2016, 1, 15002. DOI: 1038/natrevmats.2015.2. (b) K. Itami et al., “Molecular nanocarbon science: present and future”. Nano Lett. 2020, 20, 4718-4720. DOI: 10.1021/acs.nanolett.0c02143. (c) I. A. Stepek et al., “New paradigms in molecular nanocarbon science” Tetrahedron 2022, 123, 132907. DOI: 10.1016/j.tet.2022.132907.
- https://www.itbm.nagoya-u.ac.jp/en/
- Accounts: (a) K. Itami et al., “Multisubstituted olefins: Platform synthesis and applications to materials science and pharmaceutical chemistry” Chem. Soc. Jpn. 2006, 79, 811-824. DOI: 10.1246/bcsj.79.811. (b) K. Itami et al., “Platform synthesis: A useful strategy for rapid and systematic generation of molecular diversity” Chem. Eur. J. 2006, 12, 3966-3974. DOI: 10.1002/chem.200500958.
- Accounts and reviews: (a) Y. Li et al., “Chemical synthesis of carbon nanorings and nanobelts” Mater. Res. 2021, 2, 681-691. DOI: 10.1021/accountsmr.1c00105. (b) Y. Segawa et al., “Chemical synthesis of cycloparaphenylenes” Phys. Sci. Rev.2017, 2, 137-226. DOI: 10.1515/psr-2016-0102. (c) Y. Segawa et al., “Design and synthesis of carbon nanotube segments” Angew. Chem. Int. Ed. 2016, 55, 5136-5158. DOI: 10.1002/anie.201508384. (d) H. Omachi et al., “Synthesis of cycloparaphenylenes and related carbon nanorings: A step toward the controlled synthesis of carbon nanotubes” Acc. Chem. Res. 2012, 45, 1378-1389. DOI: 10.1021/ar300055x. (e) D. Imoto et al., “Carbon nanobelts: Brief history and perspective” Precis. Chem. 2023, 1, 516-523. DOI: 10.1021/prechem.3c00083.
- (a) H. Takaba et al., “Selective synthesis of [12]cycloparaphenylene” Chem. Int. Ed. 2009, 48, 6112-6116. DOI: 10.1002/anie.200902617. (b) H. Omachi et al., “A modular and size-selective synthesis of [n]cycloparaphenylenes: A step toward the selective synthesis of [n,n] single-walled carbon nanotubes” Angew. Chem. Int. Ed. 2010, 49, 10202-10205. DOI: 10.1002/anie.201005734.
- Jasti et al., “Synthesis, characterization, and theory of [9]-, [12]-, and [18]cycloparaphenylene: Carbon nanohoop structures” J. Am. Chem. Soc. 2008, 130, 17646-17647. DOI: 10.1021/ja807126u.
- https://www.tcichemicals.com/assets/brochure-pdfs/Brochure_FF081_J.pdf
- Shudo et al., “Perfluorocycloparaphenylenes” Nature Commun. 2022, 13, 3713. DOI: 10.1038/s41467-022-31530-x.
- (a) Y. Li et al., “A nonalternant aromatic belt: Methylene-bridged [6]cycloparaphenylene synthesized from pillar[6]arene” Am. Chem. Soc. 2020, 142, 12850-12856. DOI: 10.1021/jacs.0c06007. (b) H. Kono et al., “Methylene-bridged [6]-, [8]-, and [10]cycloparaphenylenes: Size-dependent properties and paratropic belt currents” J. Am. Chem. Soc. 2023, 145, 8939-8946. DOI: 10.1021/jacs.2c13208.
- https://www.tcichemicals.com/assets/brochure-pdfs/Brochure_FF122_J.pdf
- (a) Y. Nakanishi et al., “Size-selective complexation and extraction of endohedral metallofullerenes with cycloparaphenylene” Chem. Int. Ed. 2014, 53, 3102-3106. DOI: 10.1002/anie.201311268. (b) H. Ueno et al., “Cycloparaphenylene-based ionic donor-acceptor supramolecule: Isolation and characterization of Li+@C60Ì[10]CPP” Angew. Chem. Int. Ed. 2015, 54, 3707-3711. DOI: 10.1002/anie.201500544.
- (a) N. Ozaki et al., “Electrically activated conductivity and white light emission of a hydrocarbon nanoring-iodine assembly”. Chem. Int. Ed. 2017, 56, 11196-11202. DOI: 10.1002/anie.201703648. H. Ishibashi et al., “Noncovalent modification of cycloparaphenylene by catenane formation using an active metal template strategy” Angew. Chem. Int. Ed. 2023, 62, e202310613. DOI: 10.1002/anie.202310613.
- Omachi et al., “Initiation of carbon nanotube growth by well-defined carbon nanorings”. Nature Chem. 2013, 5, 572-576. DOI: 10.1038/nchem.1655.
- Povie et al., “Synthesis of a carbon nanobelt” Science 2017, 356, 172-175. DOI: 10.1126/science.aam8158.
- Povie et al., “Synthesis and size-dependent properties of [12], [16], and [24]carbon nanobelts” J. Am. Chem. Soc. 2018, 140, 10054-10059. DOI: 10.1021/jacs.8b06842.
- https://www.tcichemicals.com/assets/brochure-pdfs/Brochure_FF076_E.pdf
- Y. Cheung et al., “Synthesis of a zigzag carbon nanobelt” Nature Chem. 2021, 13, 255-259. DOI: 10.1038/s41557-020-00627-5.
- Segawa et al., “Synthesis of a Möbius carbon nanobelt”. Nature Synth. 2022, 1, 535-541. DOI: 10.1038/s44160-022-00075-8.
- Matsui et al., “All-benzene carbon nanocages: Size-selective synthesis, photophysical properties, and crystal structure”. J. Am. Chem. Soc. 2014, 136, 16452-16458. DOI: 10.1021/ja509880v.
- Segawa et al., “Topological molecular nanocarbons: all-benzene catenane and trefoil knot” Science 2019, 365, 272-276. DOI: 10.1126/science.aav5021.
- (a) K. Kawasumi et al., “A grossly warped nanographene and the consequences of multiple odd-membered-ring defects” Nature Chem. 2013, 5, 739-744. DOI: 1038/nchem.1704. (b) H.-A. Lin et al., “A water-soluble warped nanographene: Synthesis and applications for photo-induced cell death” Angew. Chem. Int. Ed. 2018, 57, 2874-2878. DOI: 10.1002/anie.201713387. (c) J. I. Urgel et al., “Negatively curved warped nanographene self-assembled on metal surfaces” J. Am. Chem. Soc. 2019, 141, 13158-13164. DOI: 10.1021/jacs.9b05501. (d) S. Matsubara et al., “Creation of negatively curved polyaromatics enabled by annulative coupling that forms an eight-membered ring” Nature Catal.2020, 3, 710-718. DOI: 10.1038/s41929-020-0487-0. (e) K. Kato et al., “Double-helix supramolecular nanofibers assembled from negatively curved nanographenes” J. Am. Chem. Soc. 2021, 143, 5465-5469. DOI: 10.1021/jacs.1c00863.
- https://products.kanto.co.jp/uploads/pj46_m_pdf/111/pdf1.pdf
- (a) Fujikawa et al., “Synthesis, structures, and properties of π-extended double helicene: A combination of planar and nonplanar π-systems” J. Am. Chem. Soc. 2015, 137, 7763-7768. DOI: 10.1021/jacs.5b03118. (b) T. Fujikawa et al., “Synthesis and structural features of quadruple helicenes: Highly distorted π systems enabled by accumulation of helical repulsions” J. Am. Chem. Soc. 2016, 138, 3587-3595. DOI: 10.1021/jacs.6b01303. (c) M. Toya et al., “Expanded [2,1][n]carbohelicenes with 15- and 17-benzene rings” J. Am. Chem. Soc. 2023, accepted.
- Krzeszewski et al., “Infinitene: A helically twisted figure-eight [12]circulene topoisomer” J. Am. Chem. Soc. 2022, 144, 862-871. DOI: 10.1021/jacs.1c10807.
- (a) Hong et al., “Unidirectional molecular assembly alignment on graphene enabled by nanomechanical symmetry breaking” Sci. Rep. 2018, 2333. DOI: 10.1038/s41598-018-20760-z. (b) T. Nishihara et al., “Ultra-narrow-band thermal exciton radiation in intrinsic one-dimensional semiconductors”. Nature Commun. 2018, 9, 3144. DOI: 10.1038/s41467-018-05598-3. (c) A. Takakura et al., “Strength of carbon nanotubes depends on their chemical structures” Nature Commun. 2019, 10, 3040. DOI: 10.1038/s41467-019-10959-7.
- (a) Sakamoto et al., “Cycloparaphenylene as a molecular porous carbon solid with uniform pores exhibiting adsorption-induced softness” Chem. Sci. 2016, 7, 4204-4210. DOI: 10.1039/C6SC00092D. (b) T. Mori et al., “Carbon nanosheets by morphology-retained carbonization of two-dimensional assembled anisotropic carbon nanorings” Angew. Chem. Int. Ed. 2018, 57, 9679-9683. DOI: 10.1002/anie.201803859.
- (a) Yanagisawa et al., “Direct C-H arylation of (hetero)arenes with aryl iodides via rhodium catalysis” J. Am. Chem. Soc. 2006, 128, 11748-11749. DOI: 10.1021/ja064500p. (b) S. Yanagisawa et al., “Programmed synthesis of tetraarylthiophenes through sequential C-H arylation” J. Am. Chem. Soc. 2009, 131, 14622-14623. DOI: 10.1021/ja906215b. (c) K. Mochida et al., “Direct arylation of polycyclic aromatic hydrocarbons through palladium catalysis” J. Am. Chem. Soc. 2011, 133, 10716-10719. DOI: 10.1021/ja202975w. (d) K. Muto et al., “Nickel-catalyzed C-H/C-O coupling of azoles with phenol derivatives” J. Am. Chem. Soc. 2012, 134, 169-172. DOI: 10.1021/ja210249h. (e) Q. Zhang et al., “Palladium-catalyzed C-H activation taken to the limit. Flattening an aromatic bowl by total arylation” J. Am. Chem. Soc. 2012, 134, 15664-15667. DOI: 10.1021/ja306992k. (f) J. Yamaguchi et al., “C-H bond functionalization: Emerging synthetic tools for natural products and pharmaceuticals” Angew. Chem. Int. Ed. 2012, 51, 8960-9009. DOI: 10.1002/anie.201201666. (g) S. Suzuki et al., “Synthesis and characterization of hexaarylbenzenes with five or six different substituents enabled by programmed synthesis” Nature Chem. 2015, 7, 227-233. DOI: 10.1038/nchem.2174. (h) T. Kawakami et al., “Catalytic C-H imidation of aromatic cores of functional molecules: Ligand-accelerated Cu catalysis and application to materials- and biology-oriented aromatics” J. Am. Chem. Soc. 2015, 137, 2460-2463. DOI: 10.1021/ja5130012. (i) Y. Saito et al., “para-C-H borylation of benzene derivatives by a bulky iridium catalyst” J. Am. Chem. Soc. 2015, 137, 5193-5198. DOI: 10.1021/jacs.5b02052. (j) Y. Segawa et al., “Synthesis of extended π-systems through C-H activation” Angew. Chem. Int. Ed. 2015, 54, 66-81. DOI: 10.1002/anie.201403729. (k) K. Muto et al., “Decarbonylative organoboron cross-coupling of esters by nickel catalysis” Nature Commun. 2015, 6, 7508. DOI: 10.1038/ncomms8508. (l) M. Shibata et al., “C-H arylation of phenanthrene with trimethylphenylsilane by Pd/o-chloranil catalysis: Computational studies on the mechanism, regioselectivity, and role of o-chloranil” J. Am. Chem. Soc. 2018, 140, 2196-2205. DOI: 10.1021/jacs.7b11260. (m) Y. Saito et al., “Selective transformation of strychnine and 1,2-disubstituted benzenes by C-H borylation” Chem 2020, 6, 985-993. DOI: 10.1016/j.chempr.2020.02.004. (n) K. Fujishiro et al., “Lithium-mediated mechanochemical cyclodehydrogenation” J. Am. Chem. Soc. 2023, 145, 8163-8175. DOI: 10.1021/jacs.3c01185. (p) K. E. Yamada et al., Angew. Chem. Int. Ed. 2023, 62, e202311770. DOI: 10.1002/anie.202311770.
- (a) Ozaki et al., “One-shot K-region-selective annulative π-extension for nanographene synthesis and functionalization” Nature Commun. 2015, 6, 6251. DOI: 10.1038/ncomms7251. (b) H. Ito et al., “Annulative π-extension (APEX): Rapid access to fused aromatics, heteroaromatics, and nanographenes” Angew. Chem. Int. Ed. 2017, 56, 11144-11164. DOI: 10.1002/anie.201701058. (c) W. Matsuoka et al., “Rapid access to nanographenes and fused heteroaromatics by palladium-catalyzed annulative π-extension reaction of unfunctionalized aromatics with diiodobiaryls” Angew. Chem. Int. Ed.2017, 56, 12224-12228. DOI: 10.1002/anie.201707486. (d) Y. Koga et al., “Synthesis of partially and fully fused polyaromatics by annulative chlorophenylene dimerization” Science 2018, 359, 435-439. DOI: 10.1126/science.aap9801. (e) H. Ito et al., “Polycyclic arene synthesis by annulative π-extension” J. Am. Chem. Soc. 2019, 141, 3-10. DOI: 10.1021/jacs.8b09232. (f) W. Matsuoka et al., “Diversity-oriented synthesis of nanographenes enabled by dearomative annulative π-extension” Nature Commun. 2021, 12, 3940. DOI: 10.1038/s41467-021-24261-y. (g) W. Matsuoka et al., “π-Extended rubrenes via dearomative annulative π-extension reaction” J. Am. Chem. Soc. 2023, 145, 658-666. DOI: 10.1021/jacs.2c11338.
- Tsuchiya et al., “Probing strigolactone receptors in Striga hermonthica with fluorescence” Science 2015, 349, 864-868. DOI: 10.1126/science.aab3831.
- (a) Ziadi et al., “Discovery of synthetic small molecules that enhance the number of stomata: C-H functionalization chemistry for plant biology” Chem. Commun. 2017, 53, 9632-9635. DOI: 10.1039/C7CC04526C. (b) Y. Toda et al., “Identification of stomatal-regulating molecules from de novo arylamine collection through aromatic C-H amination” Sci. Rep. 2022, 12, 949. DOI: 10.1038/s41598-022-04947-z. (c) A. Ueda et al., “Discovery of 2,6-dihalopurines as stomata opening inhibitors: Implication of an LRX-mediated H+-ATPase phosphorylation pathway” ACS Chem. Biol. 2023, 18, 347-355. DOI: 10.1021/acschembio.2c00771. (d) Y. Aihara et al., “Identification and improvement of isothiocyanate-based inhibitors on stomatal opening to act as drought tolerance-conferring agrochemicals” Nature Commun. 2023, 14, 2665. DOI: 10.1038/s41467-023-38102-7.
- (a) Oshima et al., “C-H activation generates period-shortening molecules that target cryptochrome in the mammalian circadian clock” Angew. Chem. Int. Ed. 2015, 54, 7193-7197. DOI: 10.1002/anie.201502942. (b) T. Oshima et al., “Cell-based screen identifies a new potent and highly selective CK2 inhibitor for modulation of circadian rhythms and cancer cell growth” Science Adv. 2019, 5, eau9060. DOI: 10.1126/sciadv.aau9060. (c) T. N. Uehara et al., “Casein kinese 1 family regulates PRR5 and TOC1 in the Arabidopsis circadian clock” Proc. Nat. Acad. Sci. 2019, 116, 11528-11536. DOI: 10.1073/pnas.1903357116. (d) S. Miller et al., “Isoform-selective regulation of mammalian cryptochromes” Nature Chem. Biol. 2020, 16, 676-685. DOI: 10.1038/s41589-020-0505-1. (e) K. Amaike et al., “Small molecules modulating mammalian biological clocks: Exciting new opportunities for synthetic chemistry” Chem 2020, 6, 2186-2198. DOI: 10.1016/j.chempr.2020.08.011. (f) D. Kolarski et al., “Photopharmacological manipulation of mammalian CRY1 for regulation of the circadian clock” J. Am. Chem. Soc. 2021, 143, 2078-2087. DOI: 10.1021/jacs.0c12280. (g) D. Kolarski et al., “Reversible modulation of circadian time with chronophotopharmacology” Nature Commun. 2021, 12, 3164. DOI: 10.1038/s41467-021-23301-x.
- G. Mizukami et al., “The AMOR arabinogalactan sugar chain induces pollen-tube competency to respond to ovular guidance” Curr. Biol. 2016, 26, 1091-1097. DOI: 10.1016/j.cub.2016.02.040.
- B. Frommer, K. Itami, “The prospects of Excellence Initiatives in research: Key ingredients for a successful academic research institute” EMBO Reports 2020, 21, e51398. DOI: 10.15252/embr.202051398.
-


 English
English
