プログラム分子構築と迅速合成触媒の開発
京都大学助手時代にプログラム分子構築の概念を打ち出し、そのための新しい手法(着脱可能な分子内配位子法や迅速合成触媒など)を開発しました[1]。プログラム分子構築の力量を示す例として、一般性のある自在合成法がなかった多置換オレフィンと拡張π電子系を主に取り上げ、それらの多様性指向型合成を達成するとともに、多彩配色蛍光分子や抗がん剤候補分子のライブラリーを構築しました。京都大学時代に開発した6化合物は市販化されるに至りました。
分子ナノカーボン科学の開拓
フラーレン、カーボンナノチューブ、グラフェンに代表されるナノカーボンは物質科学に革命を起こしました。しかし、この分野には2つの大きな未解決問題がありました。例えば、カーボンナノチューブやグラフェンは、現在の合成法では構造的に純粋な分子として合成することができません。また、理論的に提案されているに留まっている新奇な構造のナノカーボンも数多くあります。したがって、構造的に純粋あるいは全く新しいナノカーボンを提供する合成化学の開拓は、未来の物質科学の扉をひらく鍵といえます。ナノカーボンを構造的に純粋な分子として自在に合成・活用・理解することを目指し、有機化学や合成化学を基盤とした「分子ナノカーボン科学」という新領域を開拓し、ナノカーボン科学が抱えていた「混合物問題」と「合成不可能問題」に対して明快な解決法を出しました[2]。

カーボンナノリング・カーボンナノベルトの合成
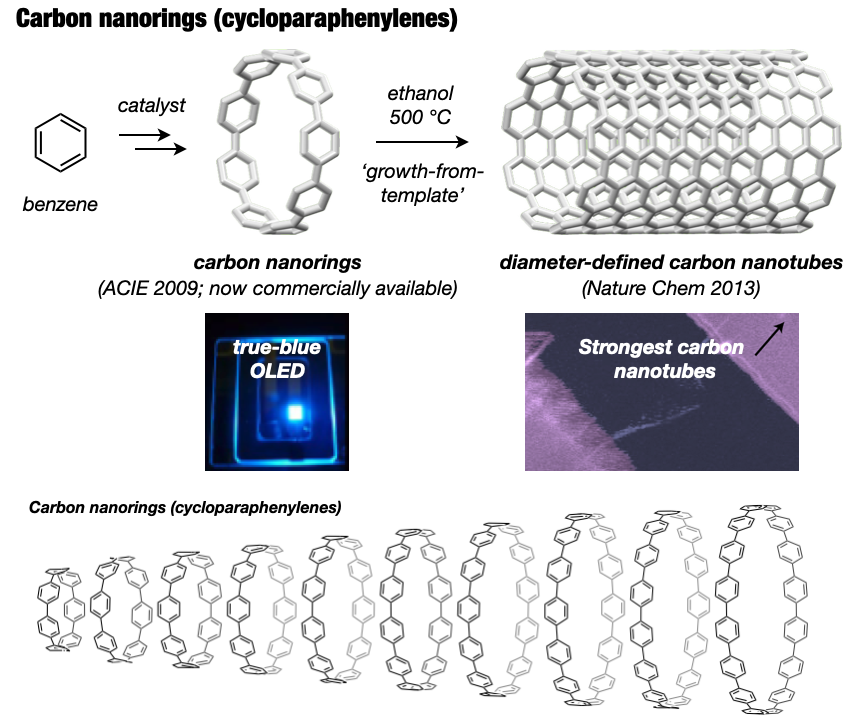
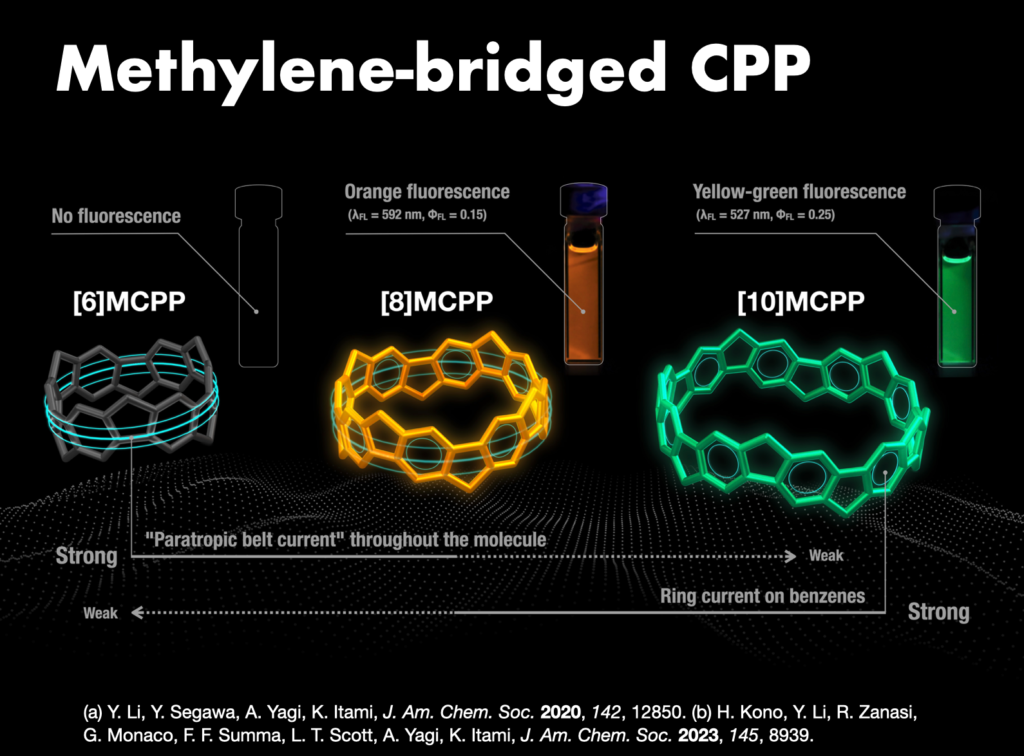
長年難攻不落とされていた究極のターゲットとして、構造的に純粋なカーボンナノチューブといえるカーボンナノリングとカーボンナノベルト(短尺ナノチューブ)の世界初の合成を目指しました[3]。2009年にカーボンナノリング(シクロパラフェニレン: CPP)の合成を達成しました[4]。米国Bertozziのグループ[5]と独立かつ同時期に世に送り出したCPPはその後世界中で研究展開され、最近ではデバイス等での実用化研究も進んでいます。代表的な成果としては、CPPの効率的合成法の開発、CPP(7化合物)の市販化[6]、全フッ素化CPP[7]やメチレン架橋CPP(市販化)[8,9]などの各種誘導体の合成、CPPの特異な光電子物性の発見、ホストゲスト化学などの超分子化学への展開[10]、刺激応答性材料の創製[11]、バイオイメージングへの応用、CPPを鋳型としたカーボンナノチューブ合成[12]があります。


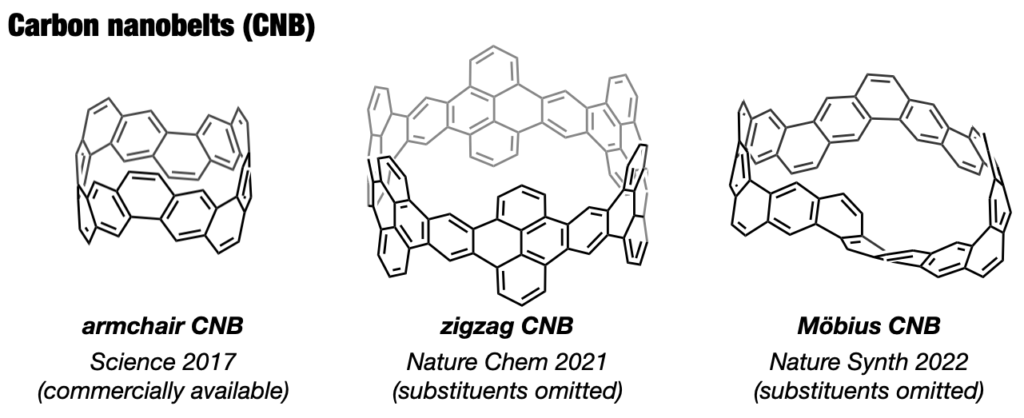
CPPと同様にカーボンナノチューブの部分構造でありながら、ナノチューブが発見される前から60年以上に渡って化学者の合成標的となっていた分子がカーボンナノベルト(CNB)です。本来剛直な平面分子であるベンゼンを極度にひずませた形ゆえ、長く化学者の挑戦を退け続けてきました。12年にわたる検討の末、2016年についにCNBの世界初の合成を達成しました[13]。最初に合成したのは(6,6)CNBですが、直径のより大きな(8,8)CNBや(12,12)CNBの合成にも成功し、特異な光電子物性や環サイズ効果を明らかにしました[14]。さらに東京化成工業による大スケールでの合成と市販化が実現し、CNBは唯一無二のベルト状分子として各方面で使われるようになりました[15]。その後、zigzag型CNB[16]やメビウス型CNB[17]の合成にも成功しました。私たちが拓いたカーボンナノリングとカーボンナノベルトの化学は今や化学における一大潮流となっています。


ユニークな幾何学構造をもつ分子ナノカーボンの合成と機能開拓
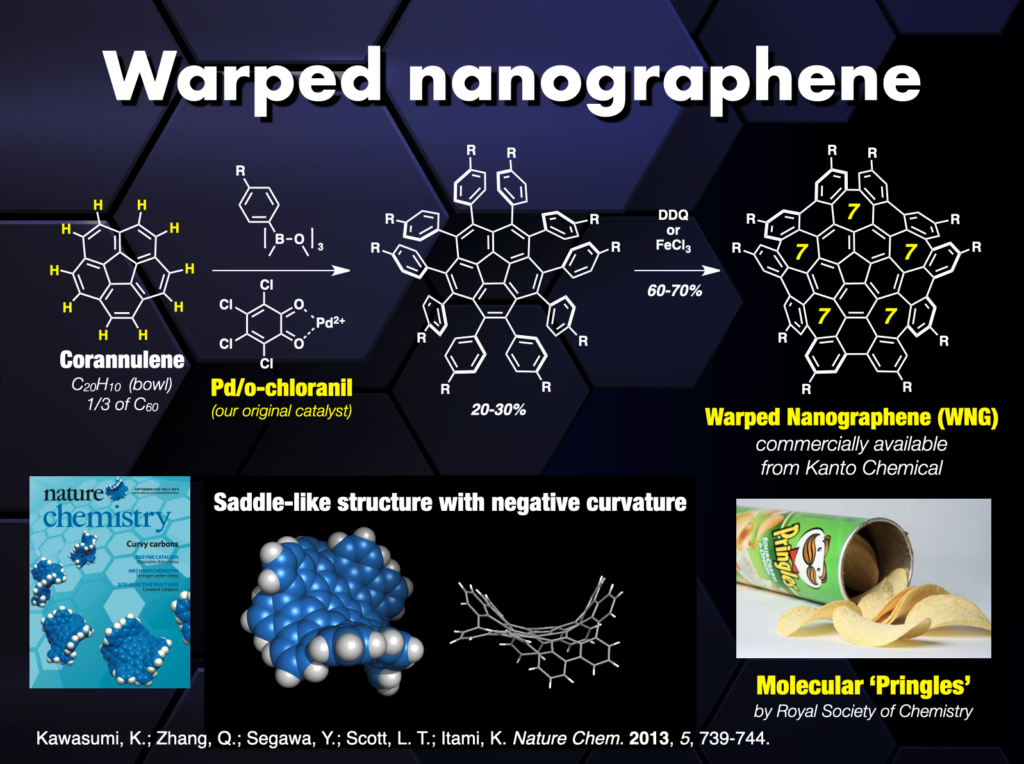
CPPやCNBに限らず、炭素原子の繋ぎ方には無限の可能性があり、「新しい炭素のカタチ」に夢とロマンを感じながら研究を行ってきました。例えば、カーボンナノケージ[18]、オールベンゼン・カテナンやトレフォイルノット[19]、3次元状に湾曲したナノグラフェン(ワープドナノグラフェン、市販化)[20,21]、拡張多重ヘリセン[22]や8の字型キラル分子インフィニテン[23]の合成に成功し、新奇分子ナノカーボンのユニークな機能を明らかにしました。この間、ERATOプロジェクトを通じて、ナノカーボン合成化学と物性物理[24]や超分子・炭素材料化学[25]との融合領域を開拓しました。また、企業との共同研究によって分子ナノカーボンは有機エレクトロニクスなどの材料科学分野で活躍の場を見つけています。



直感的な分子レゴを実現する新反応・新触媒の開発
多様な構造をもつ分子を標的とする私たちにとって、それらを創りあげる合成化学の力量は生命線です。教科書的には不可能であっても「直感的」かつ「直接的」に分子を活性化し連結する新しい化学反応を数多く開発してきました。例えば、天然から豊富に得られる芳香族化合物そのものの炭素–水素(C–H)結合を直接的に活性化し、分子ナノカーボンなどの芳香環連結分子を迅速に合成してきました。私たちが開発した独自のC–H変換触媒(約20種類)[26]は、世界中の研究者によって日常的に使われています。既に9つの触媒・配位子・反応剤が市販化されています。さらに、ナノグラフェンの迅速合成や直接変換を可能にする新しい合成方法論として、縮環π拡張(APEX)反応[27]を提案・開発し、種々の機能性分子ナノカーボンの創製につなげてきました。




ITbMの立ち上げと植物学者・動物科学者・理論化学者との協働
2012年に名古屋大学にトランスフォーマティブ生命分子研究所(ITbM)を立ち上げ、異分野の研究者が垣根なく自由に研究するMix-Labコンセプトを打ち出し、「分子で世界を変える」をスローガンに分野融合新領域を開拓しました[28]。ITbMではケミカルバイオロジーや合成化学のエッセンスを植物科学や動物科学に取り入れ、植物ケミカルバイオロジー、化学時間生物学、化学主導型イメージング科学などの新領域を開拓しました。ITbMの設立拠点長として最先端研究を牽引するとともに、主任研究者として寄生植物ストライガ抑制分子[29]、気孔制御分子[30]、生物時計制御分子[31]、植物受精効率向上分子[32]を数多く開発しました。今やITbMは世界をリードする異分野融合国際研究所に成長しました[33]。


参考論文
- Accounts: (a) K. Itami et al., “Multisubstituted olefins: Platform synthesis and applications to materials science and pharmaceutical chemistry” Chem. Soc. Jpn. 2006, 79, 811-824. DOI: 10.1246/bcsj.79.811. (b) K. Itami et al., “Platform synthesis: A useful strategy for rapid and systematic generation of molecular diversity” Chem. Eur. J. 2006, 12, 3966-3974. DOI: 10.1002/chem.200500958.
- Accounts and reviews: (a) Y. Segawa et al., “Structurally uniform and atomically precise carbon nanostructures”. Nature Rev. Mat. 2016, 1, 15002. DOI: 1038/natrevmats.2015.2. (b) K. Itami et al., “Molecular nanocarbon science: present and future”. Nano Lett. 2020, 20, 4718-4720. DOI: 10.1021/acs.nanolett.0c02143. (c) I. A. Stepek et al., “New paradigms in molecular nanocarbon science” Tetrahedron 2022, 123, 132907. DOI: 10.1016/j.tet.2022.132907.
- Accounts and reviews: (a) Y. Li et al., “Chemical synthesis of carbon nanorings and nanobelts” Mater. Res. 2021, 2, 681-691. DOI: 10.1021/accountsmr.1c00105. (b) Y. Segawa et al., “Chemical synthesis of cycloparaphenylenes” Phys. Sci. Rev.2017, 2, 137-226. DOI: 10.1515/psr-2016-0102. (c) Y. Segawa et al., “Design and synthesis of carbon nanotube segments” Angew. Chem. Int. Ed. 2016, 55, 5136-5158. DOI: 10.1002/anie.201508384. (d) H. Omachi et al., “Synthesis of cycloparaphenylenes and related carbon nanorings: A step toward the controlled synthesis of carbon nanotubes” Acc. Chem. Res. 2012, 45, 1378-1389. DOI: 10.1021/ar300055x. (e) D. Imoto et al., “Carbon nanobelts: Brief history and perspective” Precis. Chem. 2023, 1, 516-523. DOI: 10.1021/prechem.3c00083.
- (a) H. Takaba et al., “Selective synthesis of [12]cycloparaphenylene” Chem. Int. Ed. 2009, 48, 6112-6116. DOI: 10.1002/anie.200902617. (b) H. Omachi et al., “A modular and size-selective synthesis of [n]cycloparaphenylenes: A step toward the selective synthesis of [n,n] single-walled carbon nanotubes” Angew. Chem. Int. Ed. 2010, 49, 10202-10205. DOI: 10.1002/anie.201005734.
- Jasti et al., “Synthesis, characterization, and theory of [9]-, [12]-, and [18]cycloparaphenylene: Carbon nanohoop structures” J. Am. Chem. Soc. 2008, 130, 17646-17647. DOI: 10.1021/ja807126u.
- https://www.tcichemicals.com/assets/brochure-pdfs/Brochure_FF081_J.pdf
- Shudo et al., “Perfluorocycloparaphenylenes” Nature Commun. 2022, 13, 3713. DOI: 10.1038/s41467-022-31530-x.
- (a) Y. Li et al., “A nonalternant aromatic belt: Methylene-bridged [6]cycloparaphenylene synthesized from pillar[6]arene” Am. Chem. Soc. 2020, 142, 12850-12856. DOI: 10.1021/jacs.0c06007. (b) H. Kono et al., “Methylene-bridged [6]-, [8]-, and [10]cycloparaphenylenes: Size-dependent properties and paratropic belt currents” J. Am. Chem. Soc. 2023, 145, 8939-8946. DOI: 10.1021/jacs.2c13208.
- https://www.tcichemicals.com/assets/brochure-pdfs/Brochure_FF122_J.pdf
- (a) Y. Nakanishi et al., “Size-selective complexation and extraction of endohedral metallofullerenes with cycloparaphenylene” Chem. Int. Ed. 2014, 53, 3102-3106. DOI: 10.1002/anie.201311268. (b) H. Ueno et al., “Cycloparaphenylene-based ionic donor-acceptor supramolecule: Isolation and characterization of Li+@C60Ì[10]CPP” Angew. Chem. Int. Ed. 2015, 54, 3707-3711. DOI: 10.1002/anie.201500544.
- (a) N. Ozaki et al., “Electrically activated conductivity and white light emission of a hydrocarbon nanoring-iodine assembly”. Chem. Int. Ed. 2017, 56, 11196-11202. DOI: 10.1002/anie.201703648. H. Ishibashi et al., “Noncovalent modification of cycloparaphenylene by catenane formation using an active metal template strategy” Angew. Chem. Int. Ed. 2023, 62, e202310613. DOI: 10.1002/anie.202310613.
- Omachi et al., “Initiation of carbon nanotube growth by well-defined carbon nanorings”. Nature Chem. 2013, 5, 572-576. DOI: 10.1038/nchem.1655.
- Povie et al., “Synthesis of a carbon nanobelt” Science 2017, 356, 172-175. DOI: 10.1126/science.aam8158.
- Povie et al., “Synthesis and size-dependent properties of [12], [16], and [24]carbon nanobelts” J. Am. Chem. Soc. 2018, 140, 10054-10059. DOI: 10.1021/jacs.8b06842.
- https://www.tcichemicals.com/assets/brochure-pdfs/Brochure_FF076_E.pdf
- Y. Cheung et al., “Synthesis of a zigzag carbon nanobelt” Nature Chem. 2021, 13, 255-259. DOI: 10.1038/s41557-020-00627-5.
- Segawa et al., “Synthesis of a Möbius carbon nanobelt”. Nature Synth. 2022, 1, 535-541. DOI: 10.1038/s44160-022-00075-8.
- Matsui et al., “All-benzene carbon nanocages: Size-selective synthesis, photophysical properties, and crystal structure”. J. Am. Chem. Soc. 2014, 136, 16452-16458. DOI: 10.1021/ja509880v.
- Segawa et al., “Topological molecular nanocarbons: all-benzene catenane and trefoil knot” Science 2019, 365, 272-276. DOI: 10.1126/science.aav5021.
- (a) K. Kawasumi et al., “A grossly warped nanographene and the consequences of multiple odd-membered-ring defects” Nature Chem. 2013, 5, 739-744. DOI: 1038/nchem.1704. (b) H.-A. Lin et al., “A water-soluble warped nanographene: Synthesis and applications for photo-induced cell death” Angew. Chem. Int. Ed. 2018, 57, 2874-2878. DOI: 10.1002/anie.201713387. (c) J. I. Urgel et al., “Negatively curved warped nanographene self-assembled on metal surfaces” J. Am. Chem. Soc. 2019, 141, 13158-13164. DOI: 10.1021/jacs.9b05501. (d) S. Matsubara et al., “Creation of negatively curved polyaromatics enabled by annulative coupling that forms an eight-membered ring” Nature Catal.2020, 3, 710-718. DOI: 10.1038/s41929-020-0487-0. (e) K. Kato et al., “Double-helix supramolecular nanofibers assembled from negatively curved nanographenes” J. Am. Chem. Soc. 2021, 143, 5465-5469. DOI: 10.1021/jacs.1c00863.
- https://products.kanto.co.jp/uploads/pj46_m_pdf/111/pdf1.pdf
- (a) Fujikawa et al., “Synthesis, structures, and properties of π-extended double helicene: A combination of planar and nonplanar π-systems” J. Am. Chem. Soc. 2015, 137, 7763-7768. DOI: 10.1021/jacs.5b03118. (b) T. Fujikawa et al., “Synthesis and structural features of quadruple helicenes: Highly distorted π systems enabled by accumulation of helical repulsions” J. Am. Chem. Soc. 2016, 138, 3587-3595. DOI: 10.1021/jacs.6b01303. (c) M. Toya et al., “Expanded [2,1][n]carbohelicenes with 15- and 17-benzene rings” J. Am. Chem. Soc. 2023, accepted.
- Krzeszewski et al., “Infinitene: A helically twisted figure-eight [12]circulene topoisomer” J. Am. Chem. Soc. 2022, 144, 862-871. DOI: 10.1021/jacs.1c10807.
- (a) Hong et al., “Unidirectional molecular assembly alignment on graphene enabled by nanomechanical symmetry breaking” Sci. Rep. 2018, 2333. DOI: 10.1038/s41598-018-20760-z. (b) T. Nishihara et al., “Ultra-narrow-band thermal exciton radiation in intrinsic one-dimensional semiconductors”. Nature Commun. 2018, 9, 3144. DOI: 10.1038/s41467-018-05598-3. (c) A. Takakura et al., “Strength of carbon nanotubes depends on their chemical structures” Nature Commun. 2019, 10, 3040. DOI: 10.1038/s41467-019-10959-7.
- (a) Sakamoto et al., “Cycloparaphenylene as a molecular porous carbon solid with uniform pores exhibiting adsorption-induced softness” Chem. Sci. 2016, 7, 4204-4210. DOI: 10.1039/C6SC00092D. (b) T. Mori et al., “Carbon nanosheets by morphology-retained carbonization of two-dimensional assembled anisotropic carbon nanorings” Angew. Chem. Int. Ed. 2018, 57, 9679-9683. DOI: 10.1002/anie.201803859.
- (a) Yanagisawa et al., “Direct C-H arylation of (hetero)arenes with aryl iodides via rhodium catalysis” J. Am. Chem. Soc. 2006, 128, 11748-11749. DOI: 10.1021/ja064500p. (b) S. Yanagisawa et al., “Programmed synthesis of tetraarylthiophenes through sequential C-H arylation” J. Am. Chem. Soc. 2009, 131, 14622-14623. DOI: 10.1021/ja906215b. (c) K. Mochida et al., “Direct arylation of polycyclic aromatic hydrocarbons through palladium catalysis” J. Am. Chem. Soc. 2011, 133, 10716-10719. DOI: 10.1021/ja202975w. (d) K. Muto et al., “Nickel-catalyzed C-H/C-O coupling of azoles with phenol derivatives” J. Am. Chem. Soc. 2012, 134, 169-172. DOI: 10.1021/ja210249h. (e) Q. Zhang et al., “Palladium-catalyzed C-H activation taken to the limit. Flattening an aromatic bowl by total arylation” J. Am. Chem. Soc. 2012, 134, 15664-15667. DOI: 10.1021/ja306992k. (f) J. Yamaguchi et al., “C-H bond functionalization: Emerging synthetic tools for natural products and pharmaceuticals” Angew. Chem. Int. Ed. 2012, 51, 8960-9009. DOI: 10.1002/anie.201201666. (g) S. Suzuki et al., “Synthesis and characterization of hexaarylbenzenes with five or six different substituents enabled by programmed synthesis” Nature Chem. 2015, 7, 227-233. DOI: 10.1038/nchem.2174. (h) T. Kawakami et al., “Catalytic C-H imidation of aromatic cores of functional molecules: Ligand-accelerated Cu catalysis and application to materials- and biology-oriented aromatics” J. Am. Chem. Soc. 2015, 137, 2460-2463. DOI: 10.1021/ja5130012. (i) Y. Saito et al., “para-C-H borylation of benzene derivatives by a bulky iridium catalyst” J. Am. Chem. Soc. 2015, 137, 5193-5198. DOI: 10.1021/jacs.5b02052. (j) Y. Segawa et al., “Synthesis of extended π-systems through C-H activation” Angew. Chem. Int. Ed. 2015, 54, 66-81. DOI: 10.1002/anie.201403729. (k) K. Muto et al., “Decarbonylative organoboron cross-coupling of esters by nickel catalysis” Nature Commun. 2015, 6, 7508. DOI: 10.1038/ncomms8508. (l) M. Shibata et al., “C-H arylation of phenanthrene with trimethylphenylsilane by Pd/o-chloranil catalysis: Computational studies on the mechanism, regioselectivity, and role of o-chloranil” J. Am. Chem. Soc. 2018, 140, 2196-2205. DOI: 10.1021/jacs.7b11260. (m) Y. Saito et al., “Selective transformation of strychnine and 1,2-disubstituted benzenes by C-H borylation” Chem 2020, 6, 985-993. DOI: 10.1016/j.chempr.2020.02.004. (n) K. Fujishiro et al., “Lithium-mediated mechanochemical cyclodehydrogenation” J. Am. Chem. Soc. 2023, 145, 8163-8175. DOI: 10.1021/jacs.3c01185. (p) K. E. Yamada et al., Angew. Chem. Int. Ed. 2023, 62, e202311770. DOI: 10.1002/anie.202311770.
- (a) Ozaki et al., “One-shot K-region-selective annulative π-extension for nanographene synthesis and functionalization” Nature Commun. 2015, 6, 6251. DOI: 10.1038/ncomms7251. (b) H. Ito et al., “Annulative π-extension (APEX): Rapid access to fused aromatics, heteroaromatics, and nanographenes” Angew. Chem. Int. Ed. 2017, 56, 11144-11164. DOI: 10.1002/anie.201701058. (c) W. Matsuoka et al., “Rapid access to nanographenes and fused heteroaromatics by palladium-catalyzed annulative π-extension reaction of unfunctionalized aromatics with diiodobiaryls” Angew. Chem. Int. Ed.2017, 56, 12224-12228. DOI: 10.1002/anie.201707486. (d) Y. Koga et al., “Synthesis of partially and fully fused polyaromatics by annulative chlorophenylene dimerization” Science 2018, 359, 435-439. DOI: 10.1126/science.aap9801. (e) H. Ito et al., “Polycyclic arene synthesis by annulative π-extension” J. Am. Chem. Soc. 2019, 141, 3-10. DOI: 10.1021/jacs.8b09232. (f) W. Matsuoka et al., “Diversity-oriented synthesis of nanographenes enabled by dearomative annulative π-extension” Nature Commun. 2021, 12, 3940. DOI: 10.1038/s41467-021-24261-y. (g) W. Matsuoka et al., “π-Extended rubrenes via dearomative annulative π-extension reaction” J. Am. Chem. Soc. 2023, 145, 658-666. DOI: 10.1021/jacs.2c11338.
- https://www.itbm.nagoya-u.ac.jp/
- Tsuchiya et al., “Probing strigolactone receptors in Striga hermonthica with fluorescence” Science 2015, 349, 864-868. DOI: 10.1126/science.aab3831.
- (a) Ziadi et al., “Discovery of synthetic small molecules that enhance the number of stomata: C-H functionalization chemistry for plant biology” Chem. Commun. 2017, 53, 9632-9635. DOI: 10.1039/C7CC04526C. (b) Y. Toda et al., “Identification of stomatal-regulating molecules from de novo arylamine collection through aromatic C-H amination” Sci. Rep. 2022, 12, 949. DOI: 10.1038/s41598-022-04947-z. (c) A. Ueda et al., “Discovery of 2,6-dihalopurines as stomata opening inhibitors: Implication of an LRX-mediated H+-ATPase phosphorylation pathway” ACS Chem. Biol. 2023, 18, 347-355. DOI: 10.1021/acschembio.2c00771. (d) Y. Aihara et al., “Identification and improvement of isothiocyanate-based inhibitors on stomatal opening to act as drought tolerance-conferring agrochemicals” Nature Commun. 2023, 14, 2665. DOI: 10.1038/s41467-023-38102-7.
- (a) Oshima et al., “C-H activation generates period-shortening molecules that target cryptochrome in the mammalian circadian clock” Angew. Chem. Int. Ed. 2015, 54, 7193-7197. DOI: 10.1002/anie.201502942. (b) T. Oshima et al., “Cell-based screen identifies a new potent and highly selective CK2 inhibitor for modulation of circadian rhythms and cancer cell growth” Science Adv. 2019, 5, eau9060. DOI: 10.1126/sciadv.aau9060. (c) T. N. Uehara et al., “Casein kinese 1 family regulates PRR5 and TOC1 in the Arabidopsis circadian clock” Proc. Nat. Acad. Sci. 2019, 116, 11528-11536. DOI: 10.1073/pnas.1903357116. (d) S. Miller et al., “Isoform-selective regulation of mammalian cryptochromes” Nature Chem. Biol. 2020, 16, 676-685. DOI: 10.1038/s41589-020-0505-1. (e) K. Amaike et al., “Small molecules modulating mammalian biological clocks: Exciting new opportunities for synthetic chemistry” Chem 2020, 6, 2186-2198. DOI: 10.1016/j.chempr.2020.08.011. (f) D. Kolarski et al., “Photopharmacological manipulation of mammalian CRY1 for regulation of the circadian clock” J. Am. Chem. Soc. 2021, 143, 2078-2087. DOI: 10.1021/jacs.0c12280. (g) D. Kolarski et al., “Reversible modulation of circadian time with chronophotopharmacology” Nature Commun. 2021, 12, 3164. DOI: 10.1038/s41467-021-23301-x.
- G. Mizukami et al., “The AMOR arabinogalactan sugar chain induces pollen-tube competency to respond to ovular guidance” Curr. Biol. 2016, 26, 1091-1097. DOI: 10.1016/j.cub.2016.02.040.
- B. Frommer, K. Itami, “The prospects of Excellence Initiatives in research: Key ingredients for a successful academic research institute” EMBO Reports 2020, 21, e51398. DOI: 10.15252/embr.202051398.


 English
English
